Discussió teòrica sobre la prova d'estabilitat dels aerosols induïda per la fórmula d'Arrhenius
El procés necessari per al llançament dels nostres productes d'aerosol és fer una prova d'estabilitat, però trobarem que, tot i que la prova d'estabilitat ha passat, encara hi haurà diferents graus de fuites de corrosió en la producció en massa, o fins i tot problemes de qualitat del producte en massa.Per tant, encara és significatiu per a nosaltres fer una prova d'estabilitat?
Normalment parlem de 50 ℃ tres mesos de prova d'estabilitat equivalen a dos anys de cicle de prova teòric a temperatura ambient, així que d'on ve el valor teòric?Cal esmentar aquí una fórmula notable: la fórmula d'Arrhenius.L'equació d'Arrhenius és un terme químic.És una fórmula empírica de la relació entre la constant de velocitat de la reacció química i la temperatura.Molta pràctica demostra que aquesta fórmula no només és aplicable a la reacció de gas, la reacció en fase líquida i la majoria de la reacció catalítica multifàsica.
Escriptura de fórmules (exponencial)
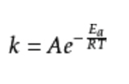
K és la constant de velocitat, R és la constant del gas molar, T és la temperatura termodinàmica, Ea és l'energia d'activació aparent i A és el factor pre-exponencial (també conegut com a factor de freqüència).
Cal tenir en compte que la fórmula empírica d'Arrhenius suposa que l'energia d'activació Ea es considera una constant independent de la temperatura, la qual cosa és coherent amb els resultats experimentals dins d'un determinat rang de temperatura.Tanmateix, a causa d'un ampli rang de temperatures o de reaccions complexes, LNK i 1/T no són una bona línia recta.Mostra que l'energia d'activació està relacionada amb la temperatura i la fórmula empírica d'Arrhenius no és aplicable a algunes reaccions complexes.
Encara podem seguir la fórmula empírica d'Arrhenius en aerosols?Segons la situació, se'n segueixen la majoria, amb algunes excepcions, sempre que, per descomptat, l'"energia d'activació Ea" del producte aerosol sigui una constant estable independent de la temperatura.
Segons l'equació d'Arrhenius, els seus factors d'influència químics inclouen els aspectes següents:
(1) Pressió: per a reaccions químiques que impliquen gas, quan les altres condicions es mantenen sense canvis (excepte el volum), augmenta la pressió, és a dir, el volum disminueix, la concentració de reactius augmenta, el nombre de molècules activades per unitat de volum augmenta, el nombre de les col·lisions efectives per unitat de temps augmenten i la velocitat de reacció s'accelera;En cas contrari, disminueix.Si el volum és constant, la velocitat de reacció es manté constant a pressió (en afegir un gas que no intervé en la reacció química).Com que la concentració no canvia, el nombre de molècules actives per volum no canvia.Però a volum constant, si afegiu els reactius, de nou, apliqueu pressió, i augmenteu la concentració dels reactius, augmenteu la velocitat.
(2) Temperatura: sempre que s'augmenti la temperatura, les molècules de reactius guanyen energia, de manera que part de les molècules originals de baixa energia es converteixen en molècules activades, augmentant el percentatge de molècules activades, augmentant el nombre de col·lisions efectives, de manera que la reacció augment de la taxa (la raó principal).Per descomptat, a causa de l'augment de la temperatura, s'accelera la velocitat de moviment molecular i augmenta el nombre de col·lisions moleculars de reactius per unitat de temps i la reacció s'accelerarà en conseqüència (causa secundària).
(3) Catalitzador: l'ús de catalitzador positiu pot reduir l'energia necessària per a la reacció, de manera que més molècules de reactius es converteixen en molècules activades, millorant considerablement el percentatge de molècules de reactius per unitat de volum, augmentant així la velocitat de reactius milers de vegades.El catalitzador negatiu és el contrari.
(4) Concentració: quan altres condicions són les mateixes, augmentar la concentració de reactius augmenta el nombre de molècules activades per unitat de volum, augmentant així la col·lisió efectiva, la velocitat de reacció augmenta, però el percentatge de molècules activades no canvia.
Els factors químics dels quatre aspectes anteriors poden explicar bé la nostra classificació dels llocs de corrosió (corrosió en fase gasosa, corrosió en fase líquida i corrosió de la interfície):
1) En la corrosió en fase gasosa, encara que el volum es manté inalterat, la pressió augmenta.A mesura que augmenta la temperatura, augmenta l'activació de l'aire (oxigen), l'aigua i el propulsor i augmenta el nombre de col·lisions, de manera que s'intensifica la corrosió en fase gasosa.Per tant, la selecció de l'inhibidor d'òxid en fase gasosa adequat és molt crítica
2) corrosió en fase líquida, a causa de l'activació de l'augment de la concentració, algunes impureses poden (com ara ions d'hidrogen, etc.) en un enllaç feble i els materials d'embalatge van produir corrosió accelerada per col·lisió, de manera que l'elecció de l'agent antioxidant en fase líquida s'ha de considerar acuradament combinat amb pH i matèries primeres.
3) La corrosió de la interfície, combinada amb la pressió, la catàlisi d'activació, l'aire (oxigen), l'aigua, el propulsor, les impureses (com ara ions d'hidrogen, etc.), la reacció completa, que resulta en corrosió de la interfície, l'estabilitat i el disseny del sistema de fórmula és molt clau .

Tornant a la pregunta anterior, per què de vegades la prova d'estabilitat funciona, però encara hi ha una anomalia pel que fa a la producció en massa?Tingueu en compte el següent:
1: disseny d'estabilitat del sistema de fórmula, com ara canvi de pH, estabilitat d'emulsificació, estabilitat de saturació, etc.
2: existeixen impureses a la matèria primera, com ara canvis en ions d'hidrogen i ions de clorur
3: estabilitat del lot de matèries primeres, ph entre lots de matèries primeres, mida de la desviació del contingut, etc.
4: l'estabilitat de les llaunes i vàlvules d'aerosol i altres materials d'embalatge, l'estabilitat del gruix de la capa d'estany, la substitució de les matèries primeres causada per l'augment del preu de les matèries primeres
5: Analitzeu acuradament totes les anomalies en la prova d'estabilitat, fins i tot si es tracta d'un petit canvi, feu un judici raonable mitjançant la comparació horitzontal, l'amplificació microscòpica i altres mètodes (aquesta és la capacitat que més manca a la indústria dels aerosols domèstics en l'actualitat)
Per tant, l'estabilitat de la qualitat del producte implica tots els aspectes, i és necessari disposar d'un sistema de qualitat complet per controlar tot el port de la cadena de subministrament (inclosos els estàndards d'adquisició, els estàndards d'investigació i desenvolupament, els estàndards d'inspecció, els estàndards de producció, etc.) per complir l'estàndard de qualitat. estratègia, per tal de garantir l'estabilitat i la conformitat finals dels nostres productes.
Malauradament, el que volem compartir actualment és que les proves d'estabilitat no poden garantir que no hi hagi problemes en les proves d'estabilitat, i la producció en massa no ha de tenir problemes.Combinant les consideracions anteriors i les proves d'estabilitat de cada producte, podem prevenir la gran majoria dels perills ocults.Encara ens esperen alguns problemes per explorar, descobrir i resoldre.Un dels atractius dels aerosols és que s'espera que més gent resolgui més misteris.
Hora de publicació: 23-juny-2022





